Pertusillo: cianotossine e contaminanti industriali nei pesci del lago della Val d’Agri




L’esito dello studio eseguito negli anni 2016-2017 su mandato del senatore Pepe (17esima Legislatura) Commissione ecomafie
Risultati e Discussioni
I risultati dell’analisi del metallo insieme alle concentrazioni di bifenili policlorurati sono riportati rispettivamente nelle Figure 2 e 3. I metalli sono stati rilevati in tutti i campioni analizzati. Tra gli elementi essenziali, Zn (Zinco) era predominante con valori compresi tra 1,15 e 4,32 grammi di peso umido g-1 (2,33 gg di peso umido g-1), mentre Cu (Rame) presentava concentrazioni molto più basse che andavano da 0,15 a 0,61 gg peso g-1 umido (Peso umido di 0,36 μg g-1) (p <0,001). La differenza rilevata nei livelli tra questi due metalli non è sorprendente, ma fa parte di uno schema generale attribuibile al fatto che il muscolo non è un tessuto attivo nell’accumulo di Cu (Zia e Khan, 1989). I livelli di Cr erano molto bassi e variavano da 0,02 a 0,05 μg di peso umido g-1 (0,03 μg di peso bagnato g-1) (p <0,001) in accordo con l’ipotesi che questo metallo generalmente non si accumuli nei pesci e quindi bassi livelli sono riportati anche dalle aree industriali mondiali (Moore e Ramamoorthy, 1984). Tra i metalli non essenziali sono state registrate le concentrazioni più alte per Hg (Mercurio) con valori compresi tra 0,27 e 0,53 gg peso umido g-1 (0,40 gg peso g-1 umido), seguite da Pb (Piombo) con livelli da 0,05 a 0,28 μg g-1 peso umido (0,14 gg peso g-1 umido), mentre Cd ha registrato i valori più bassi tra 0,03 e 0,05 gg di peso umido g-1 (0,04 gg di peso umido g-1) (p <0,001).
Un confronto con i dati in letteratura mostra un’ampia eterogeneità della concentrazione per tutti i metalli studiati. Tuttavia, i nostri livelli di Hg sono molto simili a quelli trovati da Stong et al. (2013) in carpe comuni nel Lago Chapala in Messico, ma molto più alte di quelle riportate da Vicarova et al. (2016) nella stessa specie da tre bacini idrici nella Repubblica Ceca. Per Cd e Pb, i livelli in questo studio sono in linea con i valori riportati da Yancheva et al. (2014) nel tessuto muscolare della carpa comune dal bacino di Topolnitsa in Bulgaria. Per i metalli essenziali, i nostri valori di Cr sono in buon accordo con i risultati trovati nei tessuti muscolari della carpa comune dai vivai incontaminati della Repubblica Ceca (Čelechovská et al., 2007) e del fiume Kabul in Pakistan (Yousafzai et al., 2017) . Al contrario, i nostri valori di Zn sono inferiori a quelli riportati da Yousafzai et al. (2017) e di Čelechovská et al. (2007) nel tessuto muscolare della carpa comune dal lago Keban Dam in Turchia e nelle peschiere nella Repubblica Ceca, rispettivamente. Per quanto riguarda le concentrazioni di Cu, i campioni analizzati in questo studio mostrano livelli dello stesso ordine di grandezza di quelli segnalati per la carpa comune dalla Repubblica Ceca (Čelechovská et al., 2007). Tuttavia, indipendentemente dal confronto che può essere invalidato da molti parametri biotici (specie, sesso, età o classe dimensionale, livello trofico, stato riproduttivo e metabolismo) o abiotici (temperatura, profondità e posizione dell’habitat), la presenza di metalli in grandi quantità nel cibo rappresenta l’aspetto più rilevante per la loro tossicità per l’uomo. In questo modo, per salvaguardare la salute pubblica, la Commissione Europea ha stabilito norme sulla concentrazione nel pesce per alcuni metalli pesanti (Commissione delle Comunità europee, 2001). In particolare, sono stati fissati i valori limite di Hg, Pb e Cd rispettivamente a 0,50, 0,30 e 0,05 μg g-1 di peso umido (Gazzetta ufficiale dell’Unione europea, 2006, 2014, 2015). In questo contesto, nessuno dei campioni di pesce analizzati presentava concentrazioni superiori ai limiti proposti dalla Direttiva Europea per Pb e Cd, mentre per i livelli di Hg leggermente superiori si registravano solo in due campioni (0,51 e 0,53 μg di peso umido g-1). Per quanto riguarda Cu, Zn e Cr, la Comunità europea non ha stabilito linee guida su livelli accettabili nelle parti commestibili del pesce per il consumo umano, ma è stata stabilita una differenza con altri valori limite di paesi terzi. Dal rapporto del Comitato per gli standard alimentari nel Regno Unito, Zn e Cu non dovrebbero superare il 50 e il 20 μg di peso umido g-1 (MAFF, 2000), rispettivamente, mentre nell’Elenco dei regolamenti su cibo e droga (Usero et al., 2003) il livello per Cr è di 5.5 μg g-1 di peso bagnato. Il confronto dei risultati osservati con questi livelli massimi consentiti ha rivelato che le concentrazioni di questi elementi erano molto inferiori ai limiti igienici per il consumo umano in tutti i campioni esaminati.
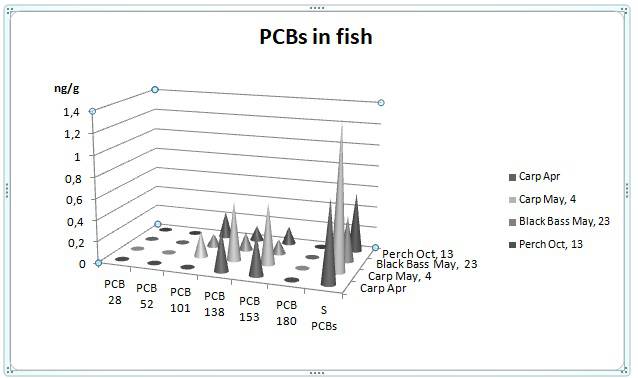
Per quanto riguarda i PCB, il sottoinsieme di sei congeneri qui testati è stato selezionato dal Consiglio internazionale per l’esplorazione del mare (ICES) come indicatore di contaminazione, poiché sono facilmente quantificabili rispetto agli altri PCB non simil-diossina e rappresentano tutti i pertinenti gradi di clorurazione. L’analisi dei dati ha mostrato che i PCB 153 e 138 erano i congeneri più frequentemente rilevati, con il 100% di rilevamento nei campioni, mentre i PCB 101 e 180 sono stati rilevati con il 50% e il 70% di frequenza, rispettivamente, e i PCB 28 e 52 erano al di sotto dei limiti di rilevamento in tutti i campioni esaminati. Le concentrazioni totali di PCB indicatori erano di 95,8-202,5 ng di peso lipidico g-1, con un valore medio di 148,6 ng di peso lipidico g-1. I PCB 153 e 138 con valori medi di 62.6 ng g-1 di peso lipidico e 55.4 ng di peso lipidico g-1 erano i più alti in concentrazione, seguiti da PCB 180 che mostra una concentrazione media di 18.7 ng di peso lipidico g-1 e PCB 101 che mostra il valore medio inferiore pari a 11,9 ng g-1 di peso lipidico. La bioconcentrazione del PCB negli organismi acquatici si correla con il grado di clorazione, la stereochimica e la lipofilicità (Fox et al., 1994). Generalmente, i congeneri con un alto grado di clorurazione sono più difficili da metabolizzare ed eliminare rispetto a meno congeneri clorurati. I dati nel pesce in questione si adattano a questo quadro generale ben basso congeneri clorurati PCB 28 e 52 al di sotto del limite di rilevamento, PCB 101 contribuendo per 8,0%, mentre i bifenili esa- ed eptaclorurati 138, 153 e 180 insieme costituivano una percentuale consistente del peso totale della PCB che rappresenta il 92,0%. Un confronto con i dati della letteratura è piuttosto complicato perché, come sopra menzionato, numerosi fattori e la loro interazione possono influenzare il livello di contaminazione tissutale del pesce.
Inoltre, ci sono rilevanti differenze metodologiche da considerare come la grande varietà di congeneri che vengono analizzati (numero e tipo di congeneri), le differenze nell’espressione dei risultati (peso umido, peso lipidico o secco) e la dimensione del pesce. A questo proposito, le variazioni delle dimensioni del campione campionate hanno un grande effetto sull’entità del carico tossico accumulato. Esiste, infatti, una grande quantità di pubblicazioni che illustrano l’accumulo di PCB con età / dimensione della fauna acquatica (Stapleton e Baker, 2003, Manchester-Neesvig et al., 2001). Quindi i pesci più grandi e potenzialmente più antichi esibiscono livelli di PCB più alti rispetto agli organismi più giovani. Nonostante ciò, non è stata osservata alcuna correlazione tra la lunghezza del pesce e le concentrazioni totali di PCB (R = 0,42; P> 0,05) nel presente studio, probabilmente come conseguenza della scarsa contaminazione nel bacino del Pertusillo. Tuttavia, in termini generali, i valori di PCB del presente studio sono inferiori a quelli riscontrati nelle carpe comuni degli stagni della Boemia meridionale e occidentale (Svobodova et al., 2004) e del lago Erie orientale in Canada (Pérez-Fuentetaja et al. , 2010). Questi indicatori PCB sono stati raccomandati dall’UE come indicatori di contaminazione da PCB perché generalmente rappresentano circa la metà dei PCB totali ndl-simili presenti negli alimenti.
Di fatto, il gruppo scientifico dell’Autorità europea per la sicurezza alimentare (EFSA) sui contaminanti nella catena alimentare (gruppo CONTAM) sceglie di utilizzare la somma di questi sei PCB come indicatore appropriato per una valutazione del rischio di ndl-PCB. Il regolamento n. 1259/2011 dell’Unione europea (UE) (Gazzetta ufficiale dell’Unione europea, 2011) ha stabilito de novo i livelli massimi tollerabili per la somma dei sei indicatori PCB non simil-diossina nelle carni muscolari di pesci d’acqua dolce che , a parte alcune eccezioni, è di 125 ng g-1 di peso umido. I nostri risultati presentati su una base di peso lipidico sono, quindi, stati convertiti in base al peso umido per conformarsi allo standard legale. In base a ciò, la somma di sei concentrazioni di congener “indicatore” era inferiore al limite consentito convenzionale in tutti i campioni esaminati (1,27 ng di peso g-1 g), suggerendo che il loro consumo può essere considerato sicuro.
Concentrazione microcistina e cilindrospermosina
Sono stati analizzati campioni superficiali di acqua quindicinale da marzo ad aprile 2012 e da ottobre 2012 a marzo 2013 per la presenza di fitoplancton. In questi campioni invernali sono state rilevate solo 16 specie; la mancanza di campioni estivi, a causa delle difficoltà nell’effettuare regolari prelievi di acqua, non ha permesso una valutazione completa della composizione fitoplanctonica. In alcuni campioni estivi analizzati dall’agenzia di protezione ambientale della Basilicata (ARPAB) nel 2014, sono state individuate altre nove specie (ARPAB, 2015). La scarsa presenza di specie fitoplanctoniche rilevate in questo studio può anche essere dovuta alla necessità di campionamenti a colonne e di un monitoraggio più sistematico. Tuttavia, anche in passato il lago mostrava la presenza di un numero limitato di specie (29 specie rilevate, Ruggiu e Saraceni, 1978).
L’86% dei campioni di tessuto totale era positivo per la presenza di microcistine, a valori di concentrazione compresi tra un minimo di 0,19 ng / g e un massimo di 2,01 ng / g b.w. (figura 4-6). Micropterus salmoides, Carassius carassius e Cyprinus carpio erano le specie con la più alta capacità di concentrazione e medie. Le analisi Elisa dei tessuti muscolari hanno mostrato la presenza di CYN nel 64% dei campioni, con concentrazioni massime a 0,78 ng / g nei muscoli (figura 7). Cyprinus carpio e Perca fluviatilis erano le specie con la più alta capacità di concentrazione e medie. Le analisi del fitoplancton ARPAB nell’estate 2014 hanno dimostrato la presenza di Aphanizomenon sp., Che potrebbe tenere conto della presenza di cylindrospermopsin (Messineo et al., 2010). A maggio 2016 sono stati analizzati quindici campioni da quattro stazioni (2 carpe da MG, 2 carpe da MB, 5 cavedani e 6 persici da MC) per la presenza di MC (figura 5), che mostra il più alto contenuto medio: 0,72 ng / g, in posatoi. Nell’anno successivo nove campioni (5 carpe da MC e 4 carpe da LD) hanno mostrato un contenuto medio (0,91 e 0,93 ng / g, rispettivamente, fig.6) superiore a quello delle carpe del 2016 (0,29 e 0,28 ng / g, rispettivamente ). La tossicità delle microcistine nel pesce dipende dall’equilibrio tra accumulo e metabolismo (Ito et al., 2002); le sensibilità specifiche delle specie osservate sono state interpretate come il risultato di differenze anatomiche, fisiologiche e comportamentali tra i vari ordini di pesce (Tencalla e Dietrich, 1997; Fischer e Dietrich, 2000); anche le capacità di disintossicazione attraverso la via glutatione-S-transferasi sono dipendenti dalla specie specifica (Cazenave et al., 2006).
L’accumulo di CYN nella fauna ittica è stato investigato nei gamberi (Cherax quadricarinatus), nei pesci arcobaleno (Melanotaenia eachamensis) (Saker e Eaglesham, 1999), nelle cozze di acqua dolce (Anodonta cygnea) (Saker et al., 2004) e salmonidi (Salmo trutta) (Messineo et al., 2010) e finfish (Berry et al., 2012).
La linea guida acuta tollerabile giornaliera (TDI) per MC-LR, proposta dall’OMS nel 1998 per un adulto di 60 kg b.w. (0,04 μg / kg di peso corporeo / giorno, Chorus and Bartram, 1999) è stato rivisto da USEPA nel 2006, con nuove linee guida proposte sviluppate per il rischio acuto e cronico (0,006 e 0,003 microcistina μg / kg di peso corporeo / giorno, rispettivamente, Protezione ambientale degli Stati Uniti Agenzia, 2006), ma nessuna linea guida per la cancerogenicità, a causa della insufficiente adeguatezza degli studi disponibili. Nello stesso 2006 l’Agenzia internazionale per la ricerca sul cancro ha classificato la microcistina-LR come potenzialmente cancerogena per l’uomo (gruppo 2B: IARC, 2010). Studi caso-controllo nella Cina sud-occidentale hanno recentemente confermato il legame tra livelli sierici di MC e presenza di carcinoma epatocellulare nell’uomo (Zheng et al., 2017).
Per un uomo adulto di peso corporeo di 60 kg e ingerendo 300 g di bastoncino di pesce, il livello di microcistina del 14,5% dei campioni muscolari analizzati dal 2010 al 2012 era pari a 1,6 volte il valore acuto TDI raccomandato dell’EPA e il livello del 36,3% di i campioni muscolari erano pari a 3,3 volte il valore cronico raccomandato. (Continua nella pagina seguente)
 0
0

